[ad_1]
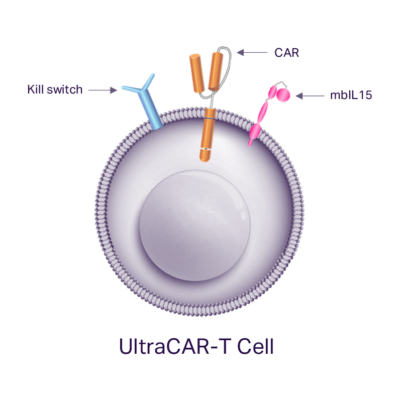
L’avantage UltraCAR-T®
- Livraison multigénique non virale
- Processus de fabrication de nuit
- Une plus grande expansion spécifique de l’antigène et in vivo persistance
- Phénotype de cellules T non épuisées de type souche
- Capacité à épuiser avec le coupe-circuit intégré
Les thérapies cellulaires CAR-T nécessitent de nouvelles approches pour un accès plus large aux patients
Les thérapies cellulaires par récepteur d’antigène chimérique T, ou CAR-T, ont montré des réponses remarquables chez les patients atteints de cancers hématologiques à cellules B ; cependant, le coût élevé et les longs délais dus à des processus de fabrication complexes et longs sont des obstacles majeurs à leur large adoption. De plus, les thérapies cellulaires CAR-T autologues et allogéniques sont confrontées à des défis dans le traitement des tumeurs solides en raison de leur épuisement rapide et de leur persistance limitée, ce qui limite la durée de leur réponse anti-tumorale dans le corps.
UltraCAR-T : une nouvelle classe de thérapie cellulaire CAR-T

La plate-forme UltraCAR-T est fondamentalement différenciée de la concurrence et a le potentiel de perturber le paysage du traitement CAR-T en augmentant l’accès des patients grâce à une fabrication rapide, des coûts de fabrication inférieurs et des résultats améliorés à l’aide de technologies avancées pour un ciblage précis des tumeurs et le contrôle de le système immunitaire.
Système d’administration multigénique non viral
Les cellules UltraCAR-T utilisent le non-viral La belle au bois dormant système, qui a été optimisé à l’aide de notre plate-forme de construction UltraVector® DNA pour fournir une grande charge utile multigénique à haute efficacité. En conséquence, les cellules UltraCAR-T sont conçues avec précision pour produire un produit cellulaire homogène qui exprime simultanément les gènes CAR, kill switch et mbIL15 spécifiques de l’antigène. Les domaines de liaison à l’antigène, de charnière et de signalisation de chaque CAR sont optimisés pour la destruction des cellules tumorales en fonction du profil d’expression de l’antigène cible. Chaque cellule UltraCAR-T est équipée de notre technologie exclusive de coupe-circuit pour permettre leur élimination contrôlée afin d’améliorer le profil de sécurité.
In vivo expansion et persistance
Le facteur clé de l’amélioration des performances UltraCAR-T est l’expression de notre interleukine 15 exclusive liée à la membrane, ou mbIL15. L’IL-15 est une cytokine régulatrice principale qui favorise l’activation et l’expansion des cellules T ainsi que la survie des cellules T mémoire pour améliorer la réponse anti-tumorale. mbIL15 est attaché à la surface cellulaire et fonctionne localement pour améliorer la fonctionnalité de la cellule UltraCAR-T sans administration systémique d’IL-15. Il est démontré que l’expression de mbIL15 améliore in vivo l’expansion en présence d’antigènes tumoraux et prévient l’épuisement des cellules UltraCAR-T conduisant à une persistance plus longue et une réponse anti-tumorale durable qui survit aux cellules CAR-T conventionnelles.
Légende de la vidéo : Vert : Cellules tumorales.
Les cellules CAR-T conventionnelles luttent pour contenir la croissance de cellules tumorales solides agressives (telles qu’exprimées dans la protéine fluorescente verte) dans une culture in vitro à long terme compatible avec leur potentiel limité de persistance en raison de l’épuisement. À l’opposé, les cellules UltraCAR-T présentent une destruction soutenue des cellules tumorales et inhibent la croissance tumorale, soulignant leur potentiel de réponse anti-tumorale durable.
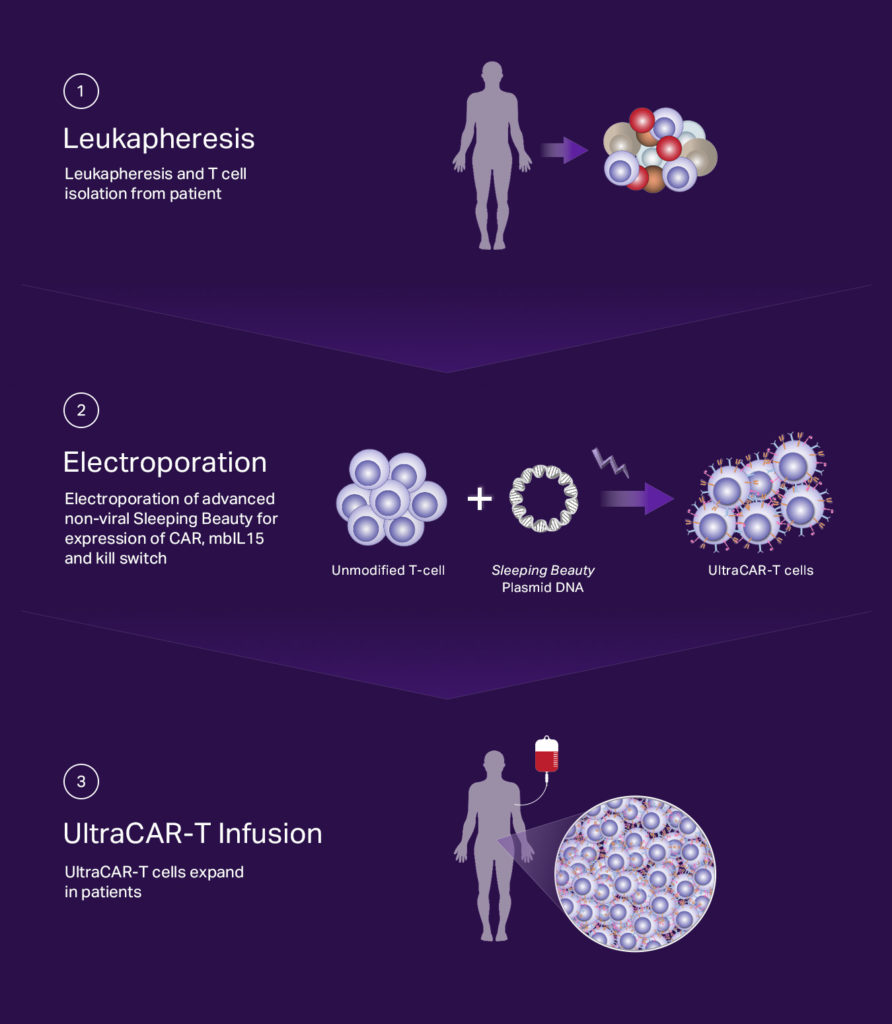
Processus de fabrication rapide et décentralisé
Les cellules UltraCAR-T sont fabriquées par un processus de fabrication rapide et rationalisé qui renonce au besoin de grandes installations centralisées, à un processus de fabrication long entraînant un épuisement et une limitation in vivo durée de vie des cellules CAR-T actuelles et contribue aux coûts élevés des thérapies. Au lieu de cela, la fabrication d’UltraCAR-T nécessite l’isolement des propres lymphocytes T du patient après une prise de sang, suivi d’un transfert de gènes non viraux à l’aide d’ADN plasmidique dans des centres médicaux. Le lendemain du transfert de gène, des cellules UltraCAR-T sont infusées au patient. Le processus de fabrication d’UltraCAR-T peut s’étendre au-delà des limites d’une installation dédiée et offre un avantage concurrentiel potentiel important dans le délai et le coût requis pour fabriquer et fournir les thérapies CAR-T aux patients.
Nous évaluons actuellement deux traitements UltraCAR-T dans le cadre d’essais cliniques. PRGN-3005 UltraCAR-T est un traitement expérimental pour le cancer de l’ovaire avancé et PRGN-3006 est un traitement expérimental pour la LAM en rechute ou réfractaire et les SMD à risque plus élevé. Nous développons actuellement une bibliothèque d’UltraCAR-T pour cibler divers antigènes tumoraux dans le but de fournir un traitement CAR-T personnalisé et autologue à tout patient cancéreux de manière rapide et économique.
[ad_2]





